■ 研究概要
本教室では、免疫応答、炎症応答を制御する分子機構を解明するための研究を主に遺伝子改変マウスを用いて行っています。
医学部学生教育では、免疫学、分子生物学の基本的な知識、考え方と共に、最先端の知見も紹介し、医学研究者としての基本的な姿勢を学んでもらうことを目標にしています。
■ 研究内容
哺乳類の生体防御機構は、自然免疫と獲得免疫との協調作用によって成り立っています。獲得免疫は、T細胞、B細胞から構成されるリンパ球に担われており、遺伝子再構成により形成される多様な受容体を介して、外来抗原の微細な構造を認識します。しかし、この獲得免疫が成立するためには、まず自然免疫が応答することが必要です。自然免疫は樹状細胞やマクロファージなどいわゆる抗原提示細胞に担われています(図)。抗原提示細胞は、一群の微生物に共通の分子構造(脂質や核酸など)を、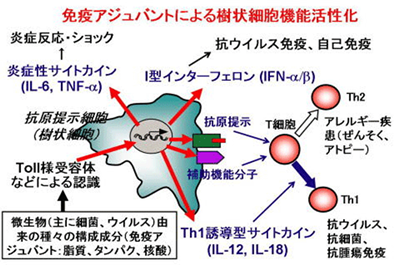 Toll様受容体(TLR)など、種々の病原体センサーを介して認識することにより活性化されます。活性化された抗原提示細胞は、T細胞に抗原提示すると共に、炎症性サイトカインやI型インターフェロン、T細胞分化誘導サイトカインなどを産生し、炎症反応を惹起し、T細胞の活性化や分化を誘導することにより、微生物感染や腫瘍に対する生体防御に必須の役割を果たします。しかし、一方、その反応のバランスが崩れると、炎症性疾患や自己免疫疾患など種々の病態を引き起こします。また、病原体センサーは、微生物ばかりでなく、尿酸、コレステロールなどの代謝産物、内因性物質にも応答し、炎症病態を引き起こすこともわかってきました。すなわち、自然免疫は、病原体や環境などの外的要因ばかりでなく、内的要因によっても活性化され、生体防御と病態の双方に諸刃の剣として重要な役割を果たしています。
当研究室では、生体防御と病態がどのようなメカニズムで制御されているかを明らかにするために、抗原提示細胞、樹状細胞に焦点を当てて、種々の遺伝子改変マウスを用いて、分子レベル、細胞レベル、個体レベルで研究を展開しています。そして、この研究を進めることにより、新たな免疫制御手段、炎症制御手段の獲得を目指しています。
Toll様受容体(TLR)など、種々の病原体センサーを介して認識することにより活性化されます。活性化された抗原提示細胞は、T細胞に抗原提示すると共に、炎症性サイトカインやI型インターフェロン、T細胞分化誘導サイトカインなどを産生し、炎症反応を惹起し、T細胞の活性化や分化を誘導することにより、微生物感染や腫瘍に対する生体防御に必須の役割を果たします。しかし、一方、その反応のバランスが崩れると、炎症性疾患や自己免疫疾患など種々の病態を引き起こします。また、病原体センサーは、微生物ばかりでなく、尿酸、コレステロールなどの代謝産物、内因性物質にも応答し、炎症病態を引き起こすこともわかってきました。すなわち、自然免疫は、病原体や環境などの外的要因ばかりでなく、内的要因によっても活性化され、生体防御と病態の双方に諸刃の剣として重要な役割を果たしています。
当研究室では、生体防御と病態がどのようなメカニズムで制御されているかを明らかにするために、抗原提示細胞、樹状細胞に焦点を当てて、種々の遺伝子改変マウスを用いて、分子レベル、細胞レベル、個体レベルで研究を展開しています。そして、この研究を進めることにより、新たな免疫制御手段、炎症制御手段の獲得を目指しています。
1.形質細胞様樹状細胞の機能、分化を制御する分子機構
形質細胞様樹状細胞(plasmacytoid dendritic cell, PDC)は、樹状細胞の一つのサブセットであり、核酸センサーTLR7,TLR9に応答して、大量のI型インターフェロン(IFN)を産生するという特性を持っています。この特性は、ウイルスに対する防御免疫ばかりでなく、自己免疫疾患の病態形成にも関与しています(T. Kaisho & T. Tanaka Trends Immunol, 29:329-336, 2008) 。我々は、PDCで高い発現を示すEtsファミリー転写因子Spi-Bが、転写因子IRF-7と相乗的に作用することにより、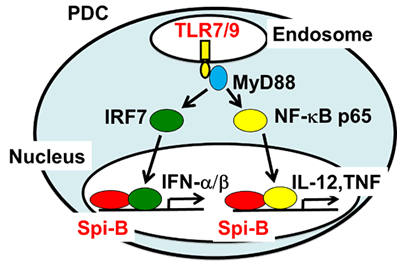 TLR7/9シグナルによるI型IFN産生誘導に関与していることを明らかにしました(I. Sasaki et al. Blood 120:4733-4743, 2012)。また、Spi-Bは、転写因子NF-κBと相乗的に作用することにより、PDCにおける炎症性サイトカイン産生誘導にも関与していました。
PDCの機能的特性を制御する分子機構のさらなる解明をめざしています。
TLR7/9シグナルによるI型IFN産生誘導に関与していることを明らかにしました(I. Sasaki et al. Blood 120:4733-4743, 2012)。また、Spi-Bは、転写因子NF-κBと相乗的に作用することにより、PDCにおける炎症性サイトカイン産生誘導にも関与していました。
PDCの機能的特性を制御する分子機構のさらなる解明をめざしています。
2.クロスプレゼンテーション能を持つ樹状細胞サブセットの機能的意義の解明
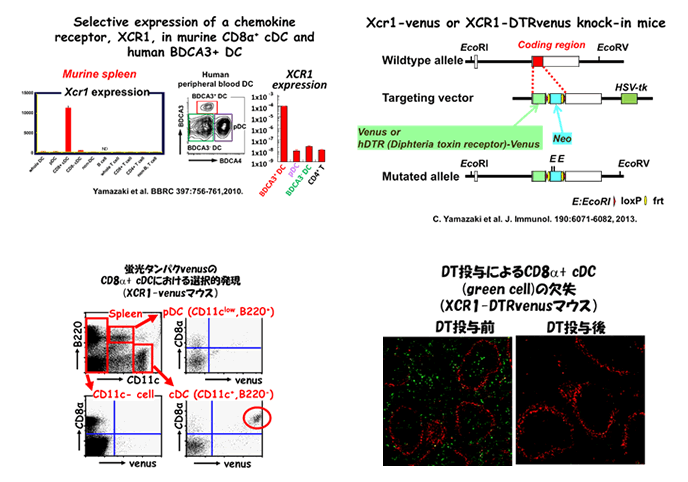
CD8α+ conventional dendritic cell (cDC)は、死細胞を取り込み、その死細胞由来の抗原を提示し、CD8T細胞応答を誘導する能力、すなわちクロスプレゼンテーション能力が高いという特性を持っています。この能力は、抗ウイルス免疫、抗腫瘍免疫に重要な機能です。また、CD8α+ cDCは、炎症性サイトカインの産生能力も高いことがわかっています。しかし、CD8α+ cDCが免疫応答、炎症性疾患にどのように関与しているかについてはまだよくわかっていません。 我々は、 ケモカイン受容体XCR1がCD8α+ cDCに選択的に発現されていることを見出しました(C. Yamazaki et al. BBRC 397:756-761, 2010)。そして、CD8α+ cDCに、蛍光タンパクvenus、あるいは蛍光タンパクとジフテリアトキシン受容体(DTR)との融合タンパク(DTRvenus)を発現させるように遺伝子改変したマウスを樹立し、クロスプレゼンテーションにおけるCD8α+ cDCの重要性を示しました(C. Yamazaki et al. J Immunol, 190:6071-6082, 2013)。 このマウスを用いることにより、種々の免疫応答、炎症性疾患におけるCD8α+ cDC の動態、機能的意義を明らかにしたいと考えています。 CD8α+ cDCは、ヒトではBDCA3+ DCに相当すると考えられていて、XCR1は、マウスではCD8α+ cDC、ヒトではBDCA3+ DCにほぼ選択的に発現されています。マウスにおいて、XCR1を発現するDCの機能的意義が明らかになれば、その知見はヒトにも応用できることが期待されます。