難病「アミロイドーシス」に“光”を。
アミロイドの無毒化による治療効果を初めて実証
| 発表日 | 令和7年8月7日(木) |
|---|
発表のポイント
- 世界的な高齢化を背景に、異常タンパク質の凝集・蓄積に起因するアミロイド疾患は近年、診断例が急増している。特に、トランスサイレチンアミロイドーシス(ATTR)は、現状で臓器移植以外に根治療法はなく、多くの患者は体内に蓄積し続ける毒性のアミロイドを無毒化することができないまま死に至るという悲惨な現状がある。
- この現状を一刻も早く改善すべく、本研究では光によって活性化され、空気中の酸素からアミロイドに対して親水性の酸素原子を化学反応により選択的に導入(光酸素化)することができる小さな触媒分子を開発し、アミロイドの無毒化を達成した。
- 高い反応性と選択性を併せ持つこの触媒は、患者由来のアミロイドに対しても光酸素化を実現し、さらに世界唯一の本疾患モデル動物である線虫の体内でも反応を進行させて、初めて治療効果を得ることに成功した。
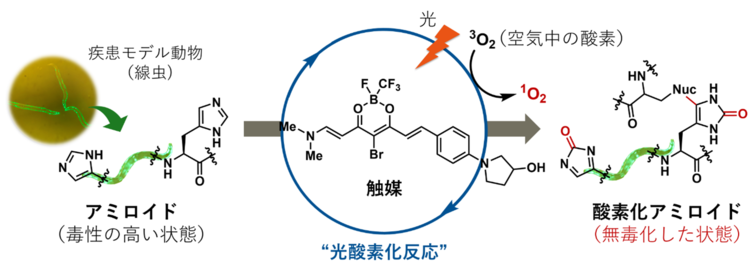
光と小さな触媒分子により、世界で初めて動物個体内でアミロイドを無毒化し、病態改善を実現
概要
東京大学 大学院薬学系研究科 有機合成化学教室 金井 求 教授と山根 三奈 特任助教らの研究グループは、同・機能病態教室 富田 泰輔 教授、堀 由起子 准教授、熊本大学 発生医学研究所 山中 邦俊 准教授、筑波大学 医学医療系/トランスボーダー医学研究センター 広川 貴次 教授、京都大学 化学研究所 梶 弘典 教授、和歌山県立医科大学 相馬 洋平 教授、杉村会 杉村病院アミロイドーシス診療研究サポートセンター 安東 由喜雄 総長、熊本大学 大学院生命科学研究部 植田 光晴 教授、富山大学 学術研究部 薬学・和漢系(薬学)構造生物学研究室 水口 峰之 教授の研究グループと共同で、難病「トランスサイレチンアミロイドーシス(ATTR)」に対し、新たな治療戦略を打ち出しました。
本技術の鍵となった触媒は、光と空気中の酸素を使った化学反応(光酸素化)により、疾患モデル動物個体内で毒性のアミロイドを無毒化することができ、治療効果を観察することに初めて成功しました。
従来の治療法は、早期患者の症状を和らげ進行を遅らせる、または健常者の発病予防に対してある程度の効果が見込めていました。しかしながら、ある一定のステージまで病気が進行した患者に対しては、体内に蓄積したアミロイドを無毒化・分解する効能はありませんでした。一方、本研究の特色である「アミロイド選択的な光酸素化」は、アミロイドの形成阻害に加え、不可逆的に沈着したアミロイドを化学反応により選択的に無毒化することで、動物個体で病態改善を実現可能とする小分子触媒の世界初の例となります。これまでに金井教授らは、アルツハイマー型認知症の原因物質(アミロイドβやタウ)を対象として種々の光酸素化触媒を開発してきましたが、臨床応用には至っていませんでした。本研究は、課題としていた治療効果の概念実証獲得を克服し、触媒的光酸素化法を臨床適用に繋げるマイルストーンを達成したと共に、これまで治療法が無かった患者にも有効な特効薬の開発につながることが期待されます。
発表内容
タンパク質の誤った折りたたみ(ミスフォールディング)とそれによる凝集は、加齢にともなって起こるタンパク質異常の代表的な現象です。特に、それらが不溶性の線維状構造となったものはアミロイド(注1)と呼ばれ、高い毒性を有することで知られています。アミロイドは体内で分解されにくく、組織や臓器に沈着することで様々な病気を引き起こす原因となります。例として、アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)、2型糖尿病、そして全身性アミロイドーシス(注2)など多岐にわたります。世界保健機関(WHO)の予測によれば、こうしたアミロイド疾患は2040年までにがんを超えて死因の第2位に入るとされています。
トランスサイレチンアミロイドーシス(ATTR)は、体内にあるトランスサイレチン(TTR:注3)というタンパク質がアミロイドを形成することで発症する難治性疾患です。本来、TTRは甲状腺ホルモンやビタミンAを運ぶ役割を担うタンパク質として私たちの体に存在していますが、その構造がなんらかの理由で変性(不安定化)すると、毒性のある形に姿を変えてしまうことがあります。こうしてできたアミロイドが心臓や腎臓、末梢神経系などに蓄積していくと、全身の臓器を徐々にむしばみ、手足のしびれや筋力の低下、心不全など生活の質を大きく損なう症状が現れるようになります。この変性のメカニズムは完全には解明されていませんが、遺伝的な要因や加齢が関与するとされています。特に、80歳以上の高齢者の約4人に1人に影響を及ぼすとも言われており、世界的な高齢化の進行とともに、その脅威は増加の一途をたどっているといえます。一方、現在の治療法の多くは「病気の進行を止める」ことが中心で、一度蓄積したアミロイドの毒性を“消す”方法はありませんでした。そのため、一度発症すると根本的な治療が難しく、有効な治療薬がないまま命を落とす患者も少なくありません。
未だ救えない命を救うために、今回、研究チームはこの難題に対し“光”と“触媒”(注4)を使った独自のアプローチにより、アミロイドそのものを無毒化するという革新的な戦略で挑みました。開発された触媒は、小さな分子でありながらアミロイド特有の構造に対して選択的に結合し、生体透過性の高い橙色光を照射することで空気中の酸素(O2)を使って、アミロイドの中のヒスチジンやメチオニンというアミノ酸に酸素原子(元素記号:O)を導入します(図1)。
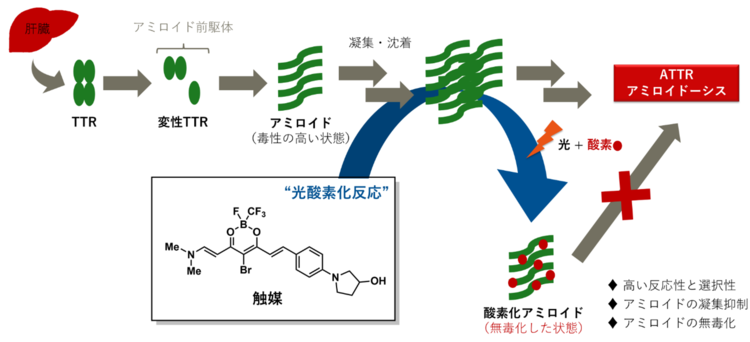
図1:アミロイドの触媒的光酸素化反応
この「光酸素化」(注5)反応は、正常なタンパク質を傷つけることなく、毒性のアミロイドだけを選択的に毒性の低い状態へと変換することができます。この高い選択性は、治療における副作用のリスクを最小限に抑えるうえで重要な特長です。本反応は、ATTRアミロイドーシス患者から実際に抽出された心臓アミロイド線維に対しても進行することが確認されており、臨床的な有用性も示唆されています。さらに、アミロイドの持つ毒性だけでなく、その凝集性(かたまりやすさ)を大幅に低下させることにも成功しました(図2)。
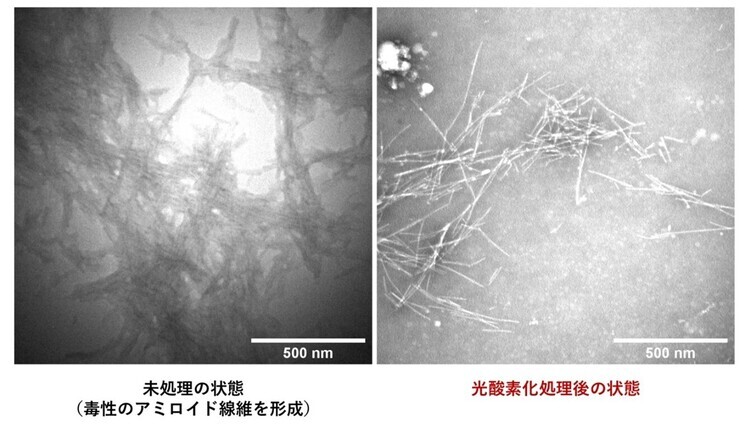
図2:光酸素化前後におけるアミロイドの凝集形態の変化
(左図)未処理の変性TTR:太い線維状の塊が密になった、高い凝集状態を撮影した電子顕微鏡画像。
(右図)光酸素化処理後の変性TTR:細い針状のものが疎らになった、低い凝集状態を撮影した電子顕微鏡画像。
本研究の中でも特に注目されるのが、ヒトのTTRアミロイドを発現させた線虫(C. elegans)を用いた実験です。ATTRアミロイドーシスの病態を再現できるモデル動物は世界的にも非常に限られており、この線虫モデルは現在、本疾患を忠実に模倣できる唯一の実用的なモデル動物とされています。この線虫は、ヒト患者と同様に運動機能の低下(末梢神経系の機能障害による動きの鈍さやしなやかさの喪失)を示しますが、光と触媒による治療を行うことで、その運動機能が有意に回復することが今回、明らかとなりました(図3)。これはつまり「既に体内に蓄積したアミロイドの毒性を除去する」ことによって病態を改善できるという、アミロイド疾患の治療戦略における新たな可能性を示した初の実証例であり、臨床応用に向けた大きな一歩であると言えます。
従来の治療法は「アミロイドの形成を防ぐ」あるいは「進行を遅らせる」といった予防・緩和的アプローチにとどまっていたのに対し、本研究は「既に蓄積してしまった毒性のアミロイドそのものを直接改変・無毒化する」という革新的な視点に基づくものであり、これまで助かることのなかった末期患者や診断・治療が遅れてしまった症例に対しても新たな治療選択肢となり得る可能性を持っています。
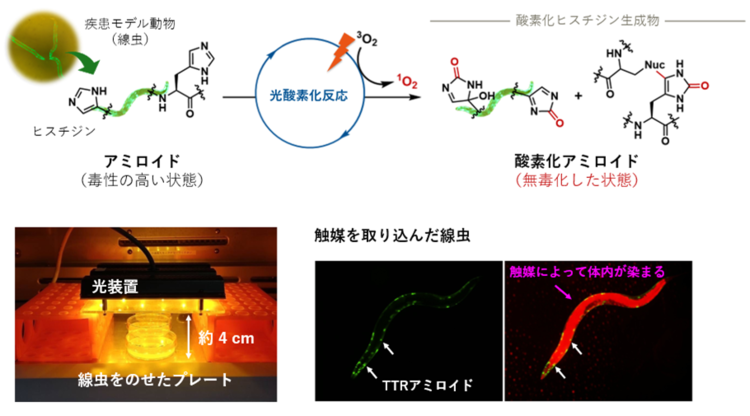
図3:モデル線虫を用いた実験系
本研究は「触媒医療(Catalysis Medicine)」(注6)という新しい疾患治療概念――すなわち化学触媒を通じて生体内の化学反応ネットワークに能動的に介入した具体的な実証例でもあります。将来的にはアルツハイマー病やパーキンソン病をはじめとした、他のアミロイド関連疾患への応用も期待されます。
発表者・研究者等情報
東京大学大学院薬学系研究科
有機合成化学教室
金井 求 教授
山根 三奈 特任助教
機能病態教室
富田 泰輔 教授
堀 由起子 准教授
熊本大学
発生医学研究所 分子細胞制御分野
山中 邦俊 准教授
大学院生命科学研究部 脳神経内科学講座
植田 光晴 教授
筑波大学 医学医療系/トランスボーダー医学研究センター
広川 貴次 教授
京都大学 化学研究所
梶 弘典 教授
和歌山県立医科大学 薬学部
相馬 洋平 教授
杉村会 杉村病院アミロイドーシス診療研究サポートセンター
安東 由喜雄 総長(研究当時:長崎国際大学薬学部 特任教授兼任)
富山大学 学術研究部 薬学・和漢系(薬学) 構造生物学研究室
水口 峰之 教授
論文情報
雑誌名:Journal of the American Chemical Society
題 名:Catalytic Photooxygenation Demonstrates Therapeutic Efficacy in
Transthyretin Amyloidosis
著者名:Mina Yamane, Hiroki Umeda, Moe Toyobe, Atsushi Iwai, Kuraudo Ishihara, Genki
Kudo, Harunobu Mitsunuma, Yukiko Hori, Taisuke Tomita, Mineyuki Mizuguchi,
Masamitsu Okada, Mitsuharu Ueda, Yukio Ando, Shigehiro A. Kawashima, Youhei
Sohma, Hironori Kaji, Takatsugu Hirokawa, Kunitoshi Yamanaka,* Motomu Kanai*
DOI:10.1021/jacs.5c06205
URL:https://doi.org/10.1021/jacs.5c06205
研究助成
本研究は、科研費「特別研究員奨励費(課題番号:JP23KJ0559)」、「基盤研究S(課題番号:JP23H05466)」、「基盤研究B(課題番号:JP25K02384、JP24K02153)」、「Core-to-Core Program(課題番号: JPJSCCA20220004)」、「JST Crest(課題番号:JPMJPR2279)」、「学術変革研究(課題番号:JP24H01787)」、AMED(課題番号:JP22ama121029j0003、JP25ek0109834)」、京都大学化学研究所・国際共共拠点「課題提案型研究課題(課題番号:2022-106)」および熊本大学発生医学研究所共同研究・共同利用支援により実施されました
用語解説
(注1)アミロイド
なんらかの理由によって、異常に折りたたまれたタンパク質が凝集してできた、線維状で不溶性の構造体のこと。これらは「クロスβシート構造」と呼ばれる安定した立体構造をとり、体内で分解されにくく、臓器や組織に沈着して様々な臓器障害をもたらす原因となる。
(注2)アミロイドーシス
アミロイドと呼ばれる異常なタンパク質が体のさまざまな臓器や組織に重合・沈着することで、臓器の機能障害を引き起こす病気の総称。
(注3)トランスサイレチン (TTR)
生体で、甲状腺ホルモンやビタミンAの担体として機能するタンパク質のことで、何らかの理由によって構造が不安定化するとアミロイドを形成する。
(注4)触媒
化学反応において自らは変化・消費されることなく、反応の活性化エネルギーを低下させることで、反応速度を上げたり、特定の反応経路を選択的に促進したりする分子のこと。特に、少量でも反応を効率よく進行させることや、反応後も再利用可能であることが特徴である。従って、原理的には触媒医療では薬物投与量を極度に低下させることができる。
(注5)光酸素化
光のエネルギーを利用して酸素(O₂)を反応に関与させ、分子中に酸素原子(元素記号:O)を導入する化学反応のこと。
(注6)触媒医療
化学触媒を用いて生体分子に対する選択的かつ繰り返し可能な変換を誘導し、触媒を通じて生体内の化学反応ネットワークに能動的に介入するという新しい疾患治療概念のこと。
問合せ先
<研究に関する問合せ>
東京大学大学院薬学系研究科
教授 金井 求(かない もとむ)
Tel:03-5841-4830 E-mail:kanai@mol.f.u-tokyo.ac.jp
特任助教 山根 三奈(やまね みな)
Tel:03-5841-4835 E-mail:yamamina@g.ecc.u-tokyo.ac.jp
熊本大学大学院生命科学研究部 脳神経内科学講座
教授 植田 光晴(うえだ みつはる)
Tel: 096-373-5893 E-mail: mueda5@kumamoto-u.ac.jp
<報道に関する問合せ>
東京大学大学院薬学系研究科 庶務チーム
Tel:03-5841-4702 E-mail:shomu@mol.f.u-tokyo.ac.jp
熊本大学 総務部総務課広報戦略室
Tel:096-342-3269 E-mail:sos-koho@jimu.kumamoto-u.ac.jp
筑波大学 広報局
Tel:029-853-2040 E-mail:kohositu@un.tsukuba.ac.jp
京都大学広報室 国際広報班
Tel:075-753-5729 E-mail:comms@mail2.adm.kyoto-u.ac.jp
公立大学法人和歌山県立医科大学 事務局広報室
Tel:073-447-2300(代表)/内線:5731 E-mail: kouhou@wakayama-med.ac.jp
富山大学 総務部総務課広報・基金室
Tel:076-445-6028 E-mail:kouhou@u-toyama.ac.jp
